がん免疫療法研究開発学部について
がん免疫療法は外科療法、化学療法、放射線療法に次ぐ、“第4のがん治療法”として注目されています。ただし、抗CTLA-4抗体、抗PD1/PD-L1抗体などの免疫チェックポイント阻害剤やキメラ抗原受容体chimeric antigen receptor(CAR)遺伝子改変T細胞療法などのがん免疫療法の臨床応用が進むにつれて、様々な課題も明らかとなっています。がん免疫療法研究開発学部では、科学的・医学的根拠に基づいた新規診断・治療法を開発しがん免疫療法をさらに発展させるため、以下のような研究をしています。
研究課題
遺伝子変異由来新規抗原(ネオアンチゲン)を標的とした個別化がん免疫治療の開発
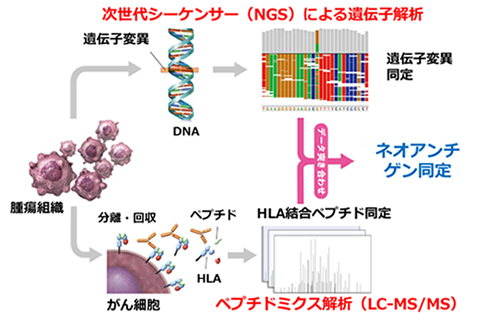
正常細胞には存在せずがん細胞にだけ特異的に生じる遺伝子変異由来抗原(ネオアンチゲン)は免疫系から“非自己”として認識され、T細胞を介した強い抗腫瘍免疫応答を誘導します。たとえば、免疫チェックポイント阻害剤(抗PD-1/PD-L1抗体や抗CTLA-4抗体)の臨床効果は遺伝子変異を多く認めるがん患者で高く、この原因は遺伝子変異由来ネオアンチゲンの免疫原性の高さによると考えられています。
ネオアンチゲンの同定法としては、がん細胞特異的な遺伝子変異配列を含みHLA分子に結合すると予測されるペプチドをbioinformatics技術で選択する手法(reverse immunology法)が現在一般的です。しかしながら、このアプローチでは、① 細胞内での抗原プロセシングの過程を予測することが難しい、② ペプチド結合性を予想できるHLA型は頻度の高いものに限られ網羅性に欠ける、などの問題点が指摘されています。実際、reverse immunology法でネオアンチゲン候補と予測されたペプチド配列のうちがん細胞表面に抗原として提示されるのはごく一部のみ(候補の数%)であると報告されています。
我々は、reverse immunology法に代わる方法として、最先端の質量分析(ペプチドミクス解析)技術を用いてがん細胞表面のHLA分子に提示されたネオアンチゲンペプチドを効率的・網羅的に同定する手法を開発中です。現在、少量(3~4mm角で重量5~60mg)の手術摘出腫瘍組織からペプチドミクス解析(LC-MS/MS)技術を用いて点突然変異(一塩基置換)由来ペプチドを同定する手法を確立しています(東京大学との共同研究)。さらに、生検検体など微量の腫瘍組織しか採取できない進行がん患者に対する臨床応用を想定し、腫瘍組織を試験管内で形質を保持しつつ培養して増やす“オルガノイド”を用いたペプチドミクス解析などを検討しています。
現在、reverse immunology法により選択されたネオアンチゲンを用いて個別化がんワクチン療法の早期臨床試験が海外で実施されていますが、ネオアンチゲン予測精度の低さが課題とされています。我々は、質量分析法で同定された候補ペプチドの物理化学特性を活用することで、ネオアンチゲンペプチドをより効率的に、正しく同定できる機械学習フィルターを開発することに成功しています(Wei F, et al. Computational and Structural Biotechnology Journal, 2024)。本研究の成果として、ペプチドミクス解析によるネオアンチゲン同定が可能となれば、同定したネオアンチゲンを標的としたワクチン・TCR遺伝子導入T細胞療法など“個別化がん免疫治療”の臨床応用を加速するものと期待されます。
免疫療法(免疫チェックポイント阻害剤)におけるバイオマーカー同定と臨床応用
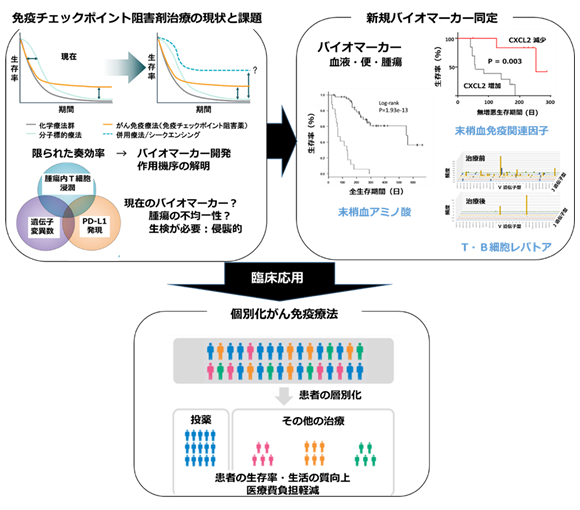
免疫チェックポイント分子・経路を介した免疫細胞抑制はがんにおける免疫逃避機構のひとつとされ、これを標的とした免疫チェックポイント阻害薬(抗PD-1/PD-L1抗体や抗CTLA-4抗体など)による治療が各種がん患者に対して臨床応用されています。ただし、免疫チェックポイント阻害薬の臨床効果は現状では20-30%の患者さんに限られるため、効果の期待できる患者さんだけを選別する“個別化免疫治療”の開発が望まれています。また、非常に高額(約1000万円/年)であるため、有効な患者を選別するバイオマーカーの開発は医療経済的にも喫緊の課題といえます。現在、抗PD-1抗体治療におけるバイオマーカーとして、① 腫瘍組織でのPD-L1発現、② 腫瘍浸潤リンパ球数、③ がん細胞での遺伝子変異数、などが用いられていますが、腫瘍組織を必要とするため患者に対する侵襲が大きいうえに、臨床的意義も定まってはいません。従って、新規バイオマーカー、特に、容易に採取可能な末梢血を用いて評価できるマーカーの開発が期待されています。
我々は、免疫チェックポイント阻害薬で治療される肺がん、腎細胞がん、尿路上皮がん、胃がん、などの患者さんから治療前後に採取した血液、便、腫瘍組織を解析することにより、治療効果・有害事象合併を予測するバイオマーカーを同定しています。これまでに、治療効果予測マーカーとして血漿中ケモカインCXCL2(Matsuo N, et al. Int J Cancer. 2019)、末梢リンパ球のTCR・BCR多様性(Nakahara Y, et al. Cancer Immunol Immunother. 2021)、血漿中アミノ酸プロファイル(Azuma, et al. Journal for ImmunoTherapy of Cancer. 2022)、血漿中の各種サイトカイン(Shibata Y, et al. Front Pharmacol. 2023; Nakahara Y, et al. Front. Cell Dev. Biol. 2024)などを報告しています。さらに、機械学習の手法を駆使して、93種の末梢血サイトカインから免疫治療の有効性と関わる重要な14種のサイトカインを抽出し、そのシグネチャーを用いて治療効果を予測できることを明らかにしています(Wei F, et al. Journal for ImmunoTherapy of Cancer. 2023)。現在、患者数を増やしてこれらの研究成果を検証するとともに、新たな視点・手法でのバイオマーカー同定を試みています。
悪性中皮腫に対するキメラ抗原受容体遺伝子導入T(CAR-T)細胞療法の開発
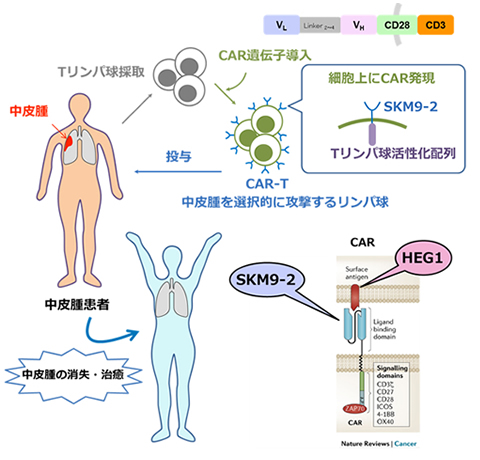
悪性中皮腫(中皮腫)はアスベスト(石綿)曝露による健康被害として社会問題となった悪性度の高い疾患であり、日本では年々患者が増加しています。中皮腫は早期診断が難しく進行した状態で発見されることがほとんどで抗がん剤や放射線療法に抵抗性を示すため、新規治療法の開発が望まれます。神奈川県立がんセンターの辻らは優れた特異性(99.0%)・感度(91.3%)で中皮腫を検出できる新規モノクローナル抗体(SKM9-2)を樹立しました(Tsuji S, et al. Sci Rep. 2017)が、その認識抗原HEG1は正常細胞にほとんど発現しないことから中皮腫に対する標的として極めて有望です。我々は、SKM9-2抗体の抗原認識配列を含むキメラ抗原受容体 [chimeric antigen receptor(CAR)] 遺伝子を導入したT細胞を作成し、中皮腫に対する新規がん免疫療法として臨床応用するために、基礎研究を実施しています。
CAR-T細胞療法は血液がんに著効が認められるものの、悪性中皮腫を含む固形がんに対しては研究開発途上です。その理由のひとつに腫瘍環境内でのCAR-T細胞の疲弊が挙げられます。我々は抗悪性中皮腫CAR-T細胞をモデルとして、疲弊に伴う細胞内シグナルを解析することによりCARの分子デザインを改変し、より効果的なCAR-T細胞療法の開発を進めています(Kouro et al. Int J Cancer. 2024)。
重粒子線照射や漢方薬と免疫療法とを併用した複合がん免疫療法の開発
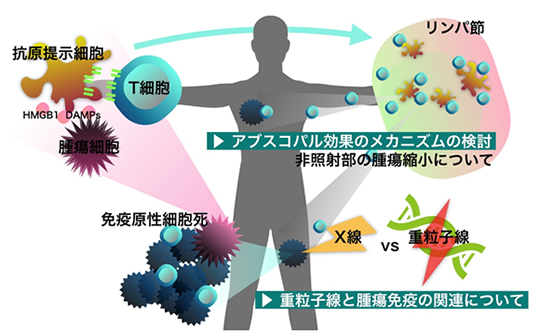
放射線(X線)治療後に照射野外の腫瘍が縮小することが知られており、アブスコパル効果と呼ばれています。このアブスコパル効果は抗腫瘍免疫応答の活性化を介することから、免疫チェックポイント阻害剤(ICI)の併用により増強すると期待され、X線治療とICI治療とを併用した多数の臨床試験が実施されています。重粒子線照射ではがん細胞におけるDNA二重鎖切断によるcGAS-STING経路活性化・DAMPs放出などを介してより強い抗腫瘍免疫応答を誘導する可能性が示唆されることから、ICI治療併用により高い抗腫瘍効果(アブスコパル効果)が期待されます。しかしながら、重粒子線照射の免疫学的影響を詳細に検討した臨床データは少なく、さらに検討が必要とされています。我々は、重粒子線治療とICI治療を併用する新規複合がん免疫療法を臨床応用するための科学的根拠を確立するために、がん患者さんの検体を用いて重粒子線照射の免疫学的影響を解明するための研究を実施しています。なお、重粒子線治療を実施できる医療施設は国内に7か所しかありませんが、神奈川県立がんセンターは重粒子線治療および免疫チェックポイント阻害剤治療の両方に関して十分な臨床経験を有することから、両者を組み合わせた新規治療法の開発が期待できます。
東洋医学において血液の滞り「瘀血」と称される病態は微小循環が障害された状態であり、腫瘍を含め様々な疾患に関与しています。抗腫瘍免疫の誘導には、腫瘍局所へT細胞をはじめとした免疫細胞の効率的な遊走・浸潤が必要ですが、「瘀血」の病態はそれらを阻害するものと推測されます。瘀血を改善する漢方方剤は「駆瘀血剤」と呼ばれ、一般臨床においても用いられいます。我々は、駆瘀血剤を用いて、「瘀血」を改善することで抗腫瘍免疫を活性化し、免疫チェックポイント阻害剤をはじめとした免役療法の効果増強へとつながる治療戦略の開発を行っています。
シングルセル解析による腫瘍特異的T細胞受容体(TCR)の効率的同定法の確立
最近、がん細胞を特異的に認識するTCRをT細胞に遺伝子導入して作製したTCR-T細胞を用いたがん免疫療法が注目されています。ただし、TCR-T細胞作製に用いるTCRは腫瘍浸潤T細胞や末梢血単核球(PBMC)を抗原ペプチドで刺激し誘導した特異的T細胞から取得することが多く、個別化治療に用いるには迅速性・確実性に課題があります。我々は、腫瘍浸潤T細胞のシングルセルRNAシークエンス(sc-RNAseq)により同定したTCRをT細胞に発現させ、作製したTCR-T細胞を用いて腫瘍細胞・がん抗原との反応性を検証することで、腫瘍特異的TCRを効率的かつ網羅的に同定する系を開発しています。また、腫瘍特異的TCR-T細胞と同一患者由来がんオルガノイドとの反応性を詳細に検討することにより、腫瘍特異的な免疫応答のメカニズムを解明するための研究を実施しています。
研究論文
2024年
2024年
- Nakahara Y, Kouro T, Motoyama S, Miura M, Fujita K, Igarashi Y, Higashijima N, Matsuo N, Himuro H, Wei F, Horaguchi S, Tsuji Y, Mano Y, Komahashi M, Saito H, Azuma K, Sasada T. Circulating IL-6 and not its circulating signaling components sIL-6R and sgp130 demonstrate clinical significance in NSCLC patients treated with immune checkpoint inhibitors. Front. Cell Dev. Biol. 2024 Jan, 11:1324898. (DOI: 10.3389/fcell.2023.1324898.)
- Wei F, Sasada T. Circulating cytokine signatures as a soluble biomarker of immune checkpoint inhibitor therapy in non-small-cell lung cancer. Genes Immun. 2024 Feb, 25:89-91 (DOI: 10.1038/s41435-023-00236-5)
- Wei F, Kouro T, Nakamura Y, Ueda H, Iiizumi S, Hasegawa K, Asahina Y, Kishida T, Morinaga S, Himuro H, Horaguchi S, Tsuji K, Mano Y, Nakamura N, Kawamura T, Sasada T. Enhancing Mass spectrometry-based tumor immunopeptide identification by machine learning filter leveraging HLA binding affinity, aliphatic index and retention time deviation. Comput Struct Biotechnol J. 2024 Feb, 23:859-869. (DOI: 10.1016/j.csbj.2024.01.023)
- Kouro T, Higashijima N, Horaguchi S, Mano Y, Kasajima R, Xiang H, Fujimoto Y, Kishi H, Hamana H, Hoshino D, Himuro H, Matsuura R, Tsuji S, Imai K, Sasada T. Novel chimeric antigen receptor-expressing T cells targeting the malignant mesothelioma-specific antigen sialylated HEG1. Int J Cancer. 2024 May 15;154(10):1828-1841. IF=5.7
- Nagasaka H, Kishida T, Kouro T, Igarashi Y, Takebe S, Yamamoto S, Kondo T, Koizumi M, Terao H, Suzuki T, Nakaigawa N. Himuro H, Wei F, Sasada T. MMP1, IL-1β, sTNFR1, and IL-6 are prognostic factors for patients with unresectable or metastatic renal cell carcinoma treated with immune checkpoint inhibitors. Int J Clin Oncol. 2024 Jun;29(6):832-839. IF=2.4
- Sekihara K, Himuro H, Toda S, Saito N, Hirayama R, Suganuma N, Sasada T, Hoshino D. Recent Trends and Potential of Radiotherapy in the Treatment of Anaplastic Thyroid Cancer. Biomedicines. 2024 Jun 10;12(6):1286. IF=3.9
- Horaguchi S, Nakahara Y, Igarashi Y, Kouro T, Wei F, Murotani K, Udagawa S, Higashijima N, Matsuo N, Murakami S, Kato T, Kondo T, Xiang H, Kasajima R, Himuro H, Tsuji K, Mano Y, Komahashi M, Miyagi Y, Saito H, Azuma K, Uehara S, Sasada T. Prognostic Significance of Plasma Neutrophil Extracellular Trap Levels in Patients with Non-Small Cell Lung Cancer Treated with Immune Checkpoint Inhibitors. Biomedicines. 2024 Aug 12;12(8):1831. IF=3.9
- Murata D, Azuma K, Murotani K, Kawahara A, Nishii Y, Tokito T, Sasada T, Hoshino T. Characterization of pre- and on-treatment soluble immune mediators and the tumor microenvironment in NSCLC patients receiving PD-1/L1 inhibitor monotherapy. Cancer Immunol Immunother. 2024 Sep 5;73(11):214. IF=4.6
- Xiang H, Kasajima R, Azuma K, Tagami T, Hagiwara A, Nakahara Y, Saito H, Igarashi Y, Wei F, Ban T, Yoshihara M, Nakamura Y, Sato S, Koizume S, Tamura T, Sasada T, Miyagi Y. Multi-omics analysis-based clinical and functional significance of a novel prognostic and immunotherapeutic gene signature derived from amino acid metabolism pathways in lung adenocarcinoma. Front Immunol. 2024 Dec 13;15:1361992. IF=5.7
- Murata D, Azuma K, Nishii Y, Murotani K, Matama G, Kawahara A, Tokito T, Sasada T, Hoshino T. The Impacts of Active and Inactive Ghrelin on Cachexia and Immune Checkpoint Inhibitor Monotherapy in Patients with Non-small Cell Lung Cancer. Chemotherapy. 2025 Jan 22:1-15. IF=2.0
- Mano Y, Igarashi Y, Komori K, Hashimoto I, Watanabe H, Takahashi K, Kano K, Fujikawa H, Yamada T, Himuro H, Kouro T, Wei F, Tsuji K, Horaguchi S, Komahashi M, Oshima T, Sasada T. Characteristics and clinical significance of immune cells in omental milky spots of patients with gastric cancer. Front Immunol. 2025 Jan 30;16:1521278. IF=5.7
- Qin XY, Shirakami Y, Honda M, Yeh SH, Numata K, Lai YY, Li CL, Wei F, Xu Y, Imai K, Takai K, Chuma M, Komatsu N, Furutani Y, Gailhouste L, Aikata H, Chayama K, Enomoto M, Tateishi R, Kawaguchi K, Yamashita T, Kaneko S, Nagaoka K, Tanaka M, Sasaki Y, Tanaka Y, Baba H, Miura K, Ochi S, Masaki T, Kojima S, Matsuura T, Shimizu M, Chen PJ, Moriwaki H, and Suzuki H. Serum MYCN as a predictive biomarker of prognosis and therapeutic response in the prevention of hepatocellular carcinoma recurrence. Int J Cancer, 2024 Aug 1;155(3):582-594. IF=5.7
2023年
2023年
- Ishihara M, Nishida Y, Kitano S, Kawai A, Muraoka D, Momose F, Harada N, Miyahara Y, Seo N, Hattori H, Takada K, Emori M, Kakunaga S, Endo M, Matsumoto Y, Sasada T, Sato E, Yamada T, Matsumine A, Nagata Y, Watanabe T, Kageyama S, Shiku H. A phase 1 trial of NY-ESO-1-specific TCR-engineered T-cell therapy combined with a lymph node-targeting nanoparticulate peptide vaccine for the treatment of advanced soft tissue sarcoma. Int J Cancer. 2023 Jun 15;152(12):2554-2566.
- Himuro H, Nakahara Y, Igarashi Y, Kouro T, Higashijima N, Matsuo N, Murakami S, Wei F, Horaguchi S, Tsuji K, Mano Y, Saito H, Azuma K, Sasada T. Clinical roles of soluble PD-1 and PD-L1 in plasma of NSCLC patients treated with immune checkpoint inhibitors. Cancer Immunol Immunother. 2023 Aug;72(8):2829-2840.
- Wei F, Azuma K, Nakahara Y, Saito H, Matsuo N, Tagami T, Kouro T, Igarashi Y, Tokito T, Kato T, Kondo T, Murakami S, Usui R, Himuro H, Horaguchi S, Tsuji K, Murotani K, Ban T, Tamura T, Miyagi Y, Sasada T. Machine learning for prediction of immunotherapeutic outcome in non-small-cell lung cancer based on circulating cytokine signatures. J Immunother Cancer. 2023 Jul;11(7):e006788.
- Murata D, Azuma K, Murotani K, Matsuo N, Matama G, Tokito T, Sasada T, Hoshino T. Survival and soluble immune mediators of immune checkpoint inhibitor-induced interstitial lung disease in patients with non-small cell lung cancer. Lung Cancer. 2023 Oct;184:107351.
- Murata D, Azuma K, Matsuo N, Murotani K, Matama G, Kawahara A, Sasada T, Tokito T, Hoshino T. Survival and biomarkers for cachexia in non-small cell lung cancer receiving immune checkpoint inhibitors. Cancer Med. 2023 Oct;12(19):19471-19479.
- Shibata Y, Kishida T, Kouro T, Wei F, Igarashi Y, Himuro H, Noguchi T, Koizumi M, Suzuki T, Osaka K, Saigusa Y, Sasada T. Immune mediators as predictive biomarkers for anti-PD-1 antibody therapy in urothelial carcinoma. Front Pharmacol. 2023 Nov 13;14:1269935.
2022年
2022年
- Azuma K, Xiang H, Tagami T, Kasajima R, KatoY, Karakawa S, Kikuchi S, Imaizumi A, Matsuo N,Ishii H, Tokito T, Kawahara A, Murotani K, Sasada T, Miyagi Y, Hoshino T. Clinical significance ofplasma-free amino acids and tryptophan metabolitesin patients with non-small cell lung cancer receivingPD-1 inhibitor: a pilot cohort study for developing a prognostic multivariate model. J Immunother Cancer. 2022 10(5): e004420.
- Ishihara M, Kitano S, Kageyama S, MiyaharaY, Yamamoto N, Kato H, Mishima H, Hattori H,Funakoshi T, Kojima T, Sasada T, Sato E, OkamotoS, Tomura D, Nukaya I, Chono H, Mineno J, Kairi MF,Diem Hoang Nguyen P, Simoni Y, Nardin A, Newell E, Fehlings M, Ikeda H, Watanabe T, Shiku H. NY-ESO-1-specific redirected T cells with endogenous TCRknockdown mediate tumor response and cytokinerelease syndrome. J Immunother Cancer. 2022; 10(6):e003811.110)
- Sekihara K, Himuro H, Saito N, Ota Y, Kouro T, Kusano Y, Minohara S, Hirayama R, Katoh H, Sasada T, Hoshino D. Evaluation of X-ray and carbon-ion beamirradiation with chemotherapy for the treatment ofcervical adenocarcinoma cells in 2D and 3D cultures. Cancer Cell Int. 2022; 22(1): 391.
- Kouro T, Himuro H, Sasada T. Exhaustion of CAR T cells: potential causes and solutions. J Transl Med. 2022;20(1):239.
- Himuro H, Sasada T. Personalized peptide vaccines. In " Cancer Vaccines as Immunotherapy of Cancer." edited by Luigi Buonaguro and Sjoerd Van der Burg, Elservier, 175-191, 2022.
- Himuro H, Sasada T. Personalized cancer vaccines targeting neoantigens. In “Handbook of Cancer and Immunology” edited by Nima Rezaei, Springer, pp 1–21 2022
過年度
2021年
- Nakahara Y, Matsutani T, Igarashi Y, Matsuo N, Himuro H, Saito H, Yamada K, MurotaniK, Hoshino T, Azuma K, Sasada T. Clinical significance of peripheral TCR and BCR repertoire diversity in EGFR/ALK wild-type NSCLC treated with anti-PD-1 antibody. Cancer Immunol Immunother. 2021 Oct;70(10):2881-2892.
- Yada E, Kasajima R, Niida A, Imoto S, Miyano S, Miyagi Y, Sasada T, Wada S. Possible Role of Cytochrome P450 1B1 in the Mechanism of Gemcitabine Resistance in Pancreatic Cancer. Biomedicines. 2021 Oct 5;9(10):1396.
2020年
- Jikuya R, Kishida T, Sakaguchi M, Yokose T, Yasui M, Hashizume A, Tatenuma T, Mizuno N, Muraoka K, Umemoto S, Kawai M, Yoshihara M, Nakamura Y, Miyagi Y, Sasada T. Galectin-9 expression as a poor prognostic factor in patients with renal cell carcinoma. Cancer Immunol Immunother. 2020, 69(10):2041-2051.
- Suekane S, Yutani S, Yamada A, Sasada T, Matsueda S, Takamori S, Toh U, Kawano K, Yoshiyama K, Sakamoto S, Sugawara S, Komatsu N, Yamada T, Naito M, Terasaki M, Mine T, Itoh K, Shichijo S, Noguchi M. Identification of biomarkers for personalized peptide vaccination in 2,588 cancer patients. Int J Oncol. 2020 56(6):1479-1489.
- Ohkuma R, Yada E, Ishikawa S, Komura D, Kubota Y, Hamada K, Horiike A, Ishiguro T, Hirasawa Y, Ariizumi H, Shida M, Watanabe M, Onoue R, Ando K, Tsurutani J, Yoshimura K, Sasada T, Aoki T, Murakami M, Norose T, Ohike N, Takimoto M, Kobayashi S, Tsunoda T, Wada S. High expression levels of polymeric immunoglobulin receptor correlate with chemoresistance and poor prognosis in pancreatic cancer. Oncol Rep. 2020, 44(1):252-262.
- Noguchi G, Nakaigawa N, Umemoto S, Kobayashi K, Shibata Y, Tsutsumi S, Yasui M, Ohtake S, Suzuki T, Osaka K, Muraoka K, Hasumi H, Kondo K, Igarashi Y, Sasada T, Kishida T, Yao M. C-reactive protein at 1 month after treatment of nivolumab as a predictive marker of efficacy in advanced renal cell carcinoma. Cancer Chemother Pharmacol. 2020, 86(1):75-85.
- Kazama K, Otake J, Shiozawa M, Sugano N, Sato S, Atsumi Y, Kano K, Murakawa M, Maezawa Y, Hashimoto I, Numata M, Satoyoshi T, Oshima T, Yukawa N, Rino Y, Masuda M, Sasada T. Distribution of Regulatory T-Cells and Other Phenotypes of T-Cells in Tumors and Regional Lymph Nodes of Colorectal Cancer Patients. In Vivo. 2020 Mar-Apr;34(2):849-856.
- Uchino Y, Muroya D, Yoshitomi M, Shichijo S, Yamada A, Sasada T, Yamada T, Okuda K, Itoh K, Yutani S. Investigation of factors associated with reduced clinical benefits of personalized peptide vaccination for pancreatic cancer. Mol Clin Oncol. 2021 Feb;14(2):39.
- 7. Ohkuma R, Yada E, Ishikawa S, Komura D, Kubota Y, Hamada K, Horiike A, Ishiguro T, Hirasawa Y, Ariizumi H, Shida M, Watanabe M, Onoue R, Ando K, Tsurutani J, Yoshimura K, Sasada T, Aoki T, Murakami M, Norose T, Ohike N, Takimoto M, Kobayashi S, Tsunoda T, Wada S. High levels of human epididymis protein 4 mRNA and protein expression are associated with chemoresistance and a poor prognosis in pancreatic cancer. Int J Oncol. 2020 Nov 12;58(1):57-69.
- Noguchi M, Arai G, Egawa S, Ohyama C, Naito S, Matsumoto K, Uemura H, Nakagawa M, Nasu Y, Eto M, Suekane S, Sasada T, Shichijo S, Yamada A, Kakuma T, Itoh K. Mixed 20-peptide cancer vaccine in combination with docetaxel and dexamethasone for castration-resistant prostate cancer: a randomized phase II trial. Cancer Immunol Immunother. 2020, 69(5):847-857.
- Igarashi Y, Sasada T. Cancer Vaccines: Toward the Next Breakthrough in Cancer Immunotherapy. J Immunol Res. 2020, Volume 2020; Article ID 5825401.
スタッフ紹介
※メールアドレスの[at]は@に直してご送信ください。
-
笹田 哲朗ささだ てつろう
役職 部長 Eメール sasada.0980e[at]kanagawa-pho.jp 専門 腫瘍免疫学、消化器外科学 -
紅露 拓こうろ たく
役職 細胞療法チームリーダー Eメール kouro.3v70h[at]kanagawa-pho.jp 専門 免疫学 -
氷室 秀知ひむろ ひでとも
役職 医長 Eメール himuro.4l00j[at]kanagawa-pho.jp 専門 腫瘍免疫学、放射線腫瘍学 -
魏 菲菲Wei Feifei
役職 任期付研究員 Eメール ffwei.8j70m[at]kanagawa-pho.jp 専門 データサイエンス、分析化学 -
辻 嘉代子つじ かよこ
役職 特別研究員 Eメール tsuji.7210m[at]kanagawa-pho.jp 専門 細胞生物学、分子生物学 -
駒橋 充こまはし みつる
役職 研究生 (日本大学) 専門 小児外科学 -
松井 友哉まつい ともや
役職 研究生 (慶應義塾大学) 専門 産婦人科学 -
塔村 友理とうむら ゆり
役職 事務補助員 Eメール toumura.5040h[at]kanagawa-pho.jp -
大橋 達夫おおはし たつお
役職 事務補助員 Eメール oohashi.ei10m[at]kanagawa-pho.jp



